| Bahasa : |
|
| Masyarakat ensiklopedia |Ensiklopedia Jawaban |Kirim pertanyaan |Pengetahuan kosakata |Upload pengetahuan |
Khlorida |
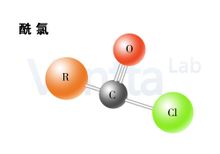 |
|
Asam klorida yang mengandung C-(O) kelompok senyawa Cl fungsional, adalah kelas asil halida, asam karboksilat dari gugus hidroksil diganti dengan pembentukan klorin turunan asam karboksilat. Cara termudah adalah klorida klorida, metil klorida, tapi sangat tidak stabil, tidak seperti klorida lain sebagai klorinasi agen melalui reaksi dengan asam format. Umum klorida adalah: asetil klorida, benzoil klorida, oksalil klorida, chloroacetyl klorida, Trichloroacetyl klorida.Chloride Definisi Model tongkat Klorida Asam klorida yang mengandung C-(O) kelompok senyawa Cl fungsional, adalah kelas asil halida, asam karboksilat dari gugus hidroksil diganti dengan pembentukan klorin turunan asam karboksilat. Cara termudah adalah klorida klorida, metil klorida, tapi sangat tidak stabil, tidak seperti klorida lain sebagai klorinasi agen melalui reaksi dengan asam format. Umum klorida adalah: asetil klorida, benzoil klorida, oksalil klorida, chloroacetyl klorida, Trichloroacetyl klorida. Juga mengacu pada turunan asam klorida dari berbagai asam oksi anorganik, rumus-M (= O) Cl. M umumnya unsur-unsur non-logam, seperti C, P, S dan sebagainya. Beberapa contoh adalah: nitrosyl klorida, tionil klorida, fosfor oksiklorida, tionil klorida dan sejenisnya. [1-2] Klorida Sifat Kimia Rendah klorida adalah cairan pedas, maju padat. Karena molekul ada hubungan, klorida titik didih lebih rendah dari asam karboksilat yang sesuai. Klorida, tidak larut dalam air, menurunkan dekomposisi air. Karena klorin memiliki elektronegativitas kuat klorida terutama untuk kuat penarik elektron efek induktif, dengan efek gugus karbonil terkonjugasi lemah, sehingga klorida ikatan C-Cl tidak lebih dari alkil diklorinasi di C-Cl ikatan lebih pendek. [1-2] Dibuat dari Metode yang paling umum untuk mempersiapkan asam klorida dengan tionil klorida, fosfor triklorida, fosfor pentaklorida dan reaksi asam karboksilat. R-COOH SOCl2 → R-COCl SO2 HCl 3R-COOH PCl3 → 3R-COCl H3PO3 R-COOH PCl5 → R-COCl POCl3 HCl Dimana tionil klorida umumnya digunakan sebagai sulfur dioksida dan hidrogen klorida adalah produk gas, mudah lepas, kemurnian yang baik dan hasil tinggi. Titik didih tionil klorida hanya 79 ° C, sedikit kelebihan tionil klorida dapat dipisahkan dengan distilasi. Dengan tionil klorida dibuat dari reaksi dimetil formamida dapat dikatalisis. Oksalil klorida juga dapat digunakan sebagai pereaksi klorinasi disiapkan oleh reaksi dengan asam klorida karboksilat: R-COOH ClCOCOCl → R-COCl CO CO2 HCl Reaksi ini juga tunduk pada dimetilformamida katalitik. Mekanisme, langkah pertama adalah dimetilformamida dan oksalil klorida bereaksi dengan garam imin antara reaktif. Dan asam karboksilat dengan reaksi antara asam klorida, dan re-dimetilformamida untuk mendapatkan: Selain klorida juga mungkin asam, karbon tetraklorida dan triphenylphosphine Appel reaksi terjadi: R-COOH Ph3P CCl4 → R-COCl Ph3PO CHCl3 Asam karboksilat dengan asam klorida sianurat klorida juga dapat dihasilkan. Ada banyak proses industri baru, seperti gas klorin, klorin dan diklorida sulfur reaksi asam, serta penggunaan langsung belerang, klorin dan asam klorida dalam respon langsung, namun yang terakhir suhu reaksi kekerasan sulit dikendalikan, harus mengurangi klorin dan dingin penukar panas air memastikan bahwa suhu reaksi yang diinginkan. [1-2] Reaksi Reaksi nukleofilik Asam klorida efek penarik elektron dari atom klorin, ditingkatkan electrophilicity karbon, asam klorida lebih rentan terhadap serangan nukleofilik, dan Cl-adalah kelompok meninggalkan baik, asil klorida melalui reaksi substitusi nukleofilik Kegiatan yang terkuat dari semua turunan asam karboksilat. Contoh paling sederhana adalah reaksi hidrolisis air klorida rendah terjadi: RCOCl H-OH → RCOOH HCl Selain itu, asam klorida dapat juga amoniak / amina membentuk amida (ammonia), dan alkohol untuk membentuk ester (alkoholisis), reaksi dengan anhidrida asam karboksilat dan ion seperti. Reaksi umumnya ditambahkan ke basis (seperti natrium hidroksida, piridin atau amina) untuk reaksi katalitik dan produk dari reaksi penyerapan hidrogen klorida. Sebagai asam karboksilat klorida, lebih reaktif daripada yang sesuai, asam klorida sebagai bahan baku dengan reaksi sering hasil yang lebih tinggi, sehingga mempersiapkan amida, ester, anhidrida, asam klorida sebagai bahan baku sering kali, tetapi tidak asam. [1-2] Organologam Dengan pereaksi Grignard, anggota dari pereaksi Grignard bereaksi dengan asam klorida keton, dan kemudian sebuah molekul kedua reagen Grignard kemudian dapat berubah menjadi tiga alkohol keton. Aktif rendah dialkil tembaga lithium reagen dan kadmium organik, reaksi menghasilkan hanya satu. Aromatik klorida umumnya kurang lemak klorida hidup. [1-2] Reaksi reduksi Reaksi reduksi: dengan hidrogenasi katalitik, litium aluminium hidrida, pengurangan hidrida aluminium diisobutil, asam klorida ke dalam alkohol primer. Dengan 1mol tri (ters-butoksi) aluminium hidrida, prinsip lithium juga aldehida. Dengan keracunan paladium klorida katalis reduksi katalitik terjadi, juga akan menghasilkan aldehida, metode ini disebut reaksi reduksi Rosenmund. [1-2] |
| Pemakai Ulasan |
|
Belum ada komentar |