| Bahasa : |
|
| Masyarakat ensiklopedia |Ensiklopedia Jawaban |Kirim pertanyaan |Pengetahuan kosakata |Upload pengetahuan |
Kalsium hidroksida |
   |
|
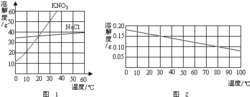
Nama Cina: Kalsium hidroksida Nama asing: Kalsium hidroksida Rumus Kimia: Ca (OH) 2 Berat: 74.09CAS :1305-62-0 Hazard: Korosif Peraturan Type: tak diatur Kalsium hidroksida adalah padatan putih bubuk. Juga dikenal sebagai kapur, kapur mati. Kalsium hidroksida memiliki basis kontinuitas, adalah basa kuat. Namun, kalsium hidroksida adalah basa kuat daripada natrium hidroksida (logam: Ca> Na), karena kelarutan kalsium hidroksida, natrium hidroksida, lebih kecil dari, solusi korosif kalsium hidroksida dan rasio hidroksida alkali Sodium kecil. Sifat dari kalsium hidroksida banyak digunakan. Sifat fisik dan kimia Putih bubuk halus, larut dalam asam, garam amonium, gliserin, sedikit larut dalam air, larut dalam alkohol, kuat basa (alkali kuat dari natrium hidroksida), kulit, kain memiliki efek korosif. Kepadatan relatif sebesar 2,24. Dipanaskan sampai 580 ℃ dehidrasi kalsium oksida, karbon dioksida dari udara untuk menyerap kalsium. Menggunakan Persiapan beton, kapur, persiapan campuran Bordeaux sebagai pestisida. Mengubah pH tanah akan menjadi jumlah yang tepat dari kapur ditambahkan ke tanah, dapat menetralkan asam, mengubah pH tanah. Disiapkan makanan aditif natrium hidroksida, menghasilkan pemutih Untuk produksi kalsium karbonat, epiklorohidrin, propilena oksida, pemutih, bubuk pemutih, desinfektan, hanya asam, agen astringent, pelunakan air, agen mencegah keasaman tanah, agen obat menghilangkan rambut, buffer, penetral, menyembuhkan agen dan obat-obatan; digunakan dalam karet, aditif petrokimia, seperti industri perminyakan ditambahkan ke minyak pelumas untuk mencegah kokas, deposisi lumpur, dalam dan korosi. [1] Sifat pedas Debu atau tetesan aerosol memiliki efek merangsang pada membran mukosa, meskipun tidak sebagus natrium hidroksida batas berat, tetapi juga dapat menyebabkan bersin dan batuk, dan basa, seperti membuat emulsi lemak, dari kulit untuk menyerap kelembaban, protein terlarut, iritasi jaringan dan korosi. Lime menghirup debu dapat menyebabkan pneumonia. Konsentrasi maksimum dari 5mg / m³. Menghirup debu, uap air dapat dihirup, kodein dan masih Aoning, dilapisi mustard krim di dada, ketika ke mata, air yang tersedia bilas secepat mungkin, dan kemudian 5% amonium klorida atau 0,01% Cana-EDTA solusi, bilas, dan kemudian 0,5% larutan tetrakain ditambahkan tetes demi tetes. Pekerjaan harus memperhatikan untuk melindungi organ pernapasan, mengenakan overall dengan serat debu, sarung tangan, kacamata, debu disegel dan dilapisi dengan salep minyak untuk mencegah inhalasi debu. Analisis Pembubaran Bahan yang paling padat terlarut dalam air menyerap panas, dengan prinsip gerakan seimbang, saat suhu naik, keseimbangan panas dalam mendukung arah, oleh karena itu, kelarutan zat ini meningkat dengan suhu, seperti KNO ₃, NH ₄ NO ₃ dan sebagainya. Ada beberapa zat terlarut ketika fenomena eksotermis, secara umum, kelarutannya menurun dengan meningkatnya suhu, seperti kalsium hidroksida. Kelarutan kalsium hidroksida dengan naiknya suhu dengan masalah ini, ada penjelasan memiliki dua kalsium hidroksida hidrat [Ca (OH) ₂ · 2H ₂ O dan Ca (OH) ₂ · 12H ₂ O]. Kedua kelarutan hidrat yang lebih besar, anhidrat kelarutan sangat rendah kalsium hidroksida. Seperti suhu naik, hidrat kristal anhidrat kalsium hidroksida secara bertahap perubahan, oleh karena itu, kelarutan kalsium hidroksida menurun dengan meningkatnya suhu. Sistem menafsirkan kelarutan kalsium hidroksida sebagian besar akan di luar lingkup pengetahuan kurikulum SMP. Melarutkan senyawa ionik dapat dibagi menjadi dua proses. Pertama padatan ionik senyawa afinitas dengan solvasi air terjadi (senyawa ion dapat hanya dianggap pertama dengan "unsur-unsur" dalam bentuk menjadi pelarut), maka pelarut ini telah memasuki "molekul" bentuk ion ionisasi terjadi. Proses 1 (yaitu, proses ionisasi) hanya dapat menjadi proses endotermik (dari sudut pandang sistem potensial listrik energi dibayangkan). Proses 2 (yaitu proses pelarut) belum tentu efek termal. Padat Ca kami (OH) ₂ larut dalam air sebagai contoh. Sistem sebelum pembubaran kalsium hidroksida padat dan air. Untuk proses 2:. Ca (OH) ₂ (padat) NH ₂ O → Ca (OH) ₂ NH ₂ O (solusi) efek termal tergantung pada kalsium hidroksida dengan air untuk membentuk kompleks yang Ca (OH) ₂ NH ₂ O dalam bentuk. (nilai n tergantung orbit elektron kosong jumlah kalsium dan kondisi eksternal lainnya seperti kondisi suhu, dll). Bahkan energi dan kalsium hidroksida dengan air untuk membentuk dan substansi. Pembentukan kompleks dari proses ini adalah proses eksotermik. Proses ini dapat terjadi dengan pembentukan 2 (yaitu ionisasi): Ca (OH) ₂. NH ₂ O → Ca (H ₂ O) n2 2 OH- Karena kalsium dan air molekul dengan efek eksotermis proses besar, hal ini termasuk dalam Proses 1, atas proses 1 dan proses 2 yang lain efek termal dalam proses, proses pelarutan kalsium hidroksida efek panas total diletakkan panas. Proses kesetimbangan suhu akan larut dalam arah yang berlawanan, sehingga kelarutan kalsium hidroksida menurun dengan kenaikan temperatur. Setelah sistem pembubaran energi total lebih besar dari perbandingan dilarutkan sebelum pembubaran. Kelebihan energi dalam bentuk pelepasan panas. [2] |
| Pemakai Ulasan | Semua Ulasan [ 1 ]>>> |
| ||||